Secciones
Servicios
Destacamos
Secciones
Servicios
Destacamos

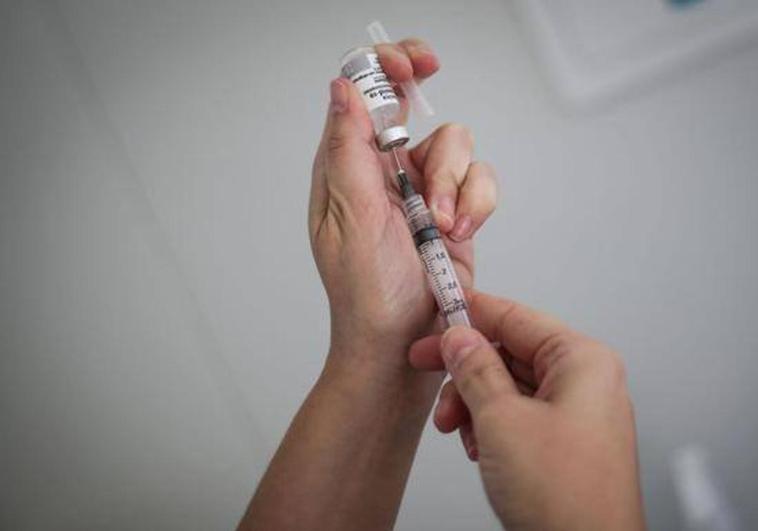
La vacuna española contra la covid, conocida como 'Bimervax' de la farmacéutica Hipra, ha sido aautorizada para su comercialización este jueves por la Agencia Europea del Medicamento, EMA, dado que ha mostrado ser, al menos, tan eficaz como Comirnaty para restablecer la protección frente al coronavirus en personas a partir de los 16 años.
Lo ha dicho en rueda de prensa la vicepresidenta ejecutiva y directora de I+D y Registros de la farmacéutica, Elia Torroella, junto al director de la División de Salud Humana de Hipra, Carles Fàbrega.
La EMA la ha aprobado como dosis de refuerzo en mayores de 16 años que hayan sido vacunados previamente al menos seis meses antes con una vacuna de Pfizer o Moderna. De esta forma, la Comisión Europea otorgará la autorización de comercialización para que pueda distribuirse en todos los Estados miembro de la UE y desde la farmacéutica catalana han anunciado que pedirán la autorización de su vacuna a países de fuera de Europa.
La evaluación científica de esta vacuna comenzó el pasado 20 de marzo y el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la EMA, formado por expertos de las autoridades competentes de los diferentes Estados miembros de la UE, entre ellos la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), y ha completado esta evaluación concluyendo por consenso que dispone de datos suficientemente sólidos sobre su calidad, seguridad y eficacia. Es decir, que el balance beneficio/riesgo es positivo.
Desde la AEMPS explican que el principal estudio realizado con la vacuna Bimervax es un ensayo clínico que comparó la respuesta inmunitaria desencadenada por esta nueva vacuna con la desencadenada por la vacuna de ARNm autorizada Comirnaty, de BioNTech/Pfizer contra SARS-CoV-2 en su variante original (Wuhan). Este ensayo recibió el visto bueno de la AEMPS el pasado 1 de febrero de 2022.
En él participaron 765 adultos que habían completado previamente la vacunación primaria con dos dosis de Pfizer y que posteriormente recibieron una dosis de refuerzo de Bimervax o Comirnaty. Aunque Bimervax desencadenó la producción de niveles más bajos de anticuerpos contra la cepa original de SARS-CoV-2 que Comirnaty, esta condujo a niveles más altos de anticuerpos contra las variantes beta y ómicron, así como niveles comparables contra la variante delta.
El estudio sobre esta vacuna concluyó que Bimervax administrado como refuerzo produce una respuesta inmunitaria adecuada también en adolescentes, con una producción de anticuerpos comparable a la observada en adultos (de 18 años o más) que recibieron Bimervax.
El perfil de seguridad de Bimervax es comparable al de otras vacunas frente a la covid-19. Los efectos secundarios más comunes observados fueron dolor en el lugar de la inyección, dolor de cabeza, cansancio y dolor muscular. Por lo general, según la EMA, estos fueron de leves a moderados y desaparecieron unos pocos días después de la vacunación.
La seguridad y eficacia de la vacuna continuarán siendo monitorizadas a medida que la vacuna se use en toda la Unión Europea, a través del sistema de farmacovigilancia europeo y estudios adicionales por parte de la empresa y las autoridades competentes. En relación a esto, Hipra está obligada a proporcionar actualizaciones periódicas de seguridad.
La Comisión Europea será ahora la responsable de otorgar la autorización de comercialización para que esta vacuna pueda distribuirse en todos los Estados miembro de la UE, como sucede con el resto de medicamentos autorizados por procedimiento centralizado.
La vacuna de Hipra frente a la covid-19 está basada en una proteína recombinante heterodimérica que contiene el sitio de unión al receptor (RBD, por sus siglas en inglés) de la proteína S (de spike o proteína espiga en español) de las variantes alfa y beta del SARS-CoV-2. Esto significa que esta vacuna bivalente contiene información para inducir una respuesta en forma de anticuerpos contra dos variantes del SARS-CoV-2. Este antígeno está acompañado de un adyuvante que incrementa la respuesta inmune.
El ministro de Sanidad, José Miñones, ha asegurado que esta recomendación de autorización por parte de la EMA es «un hito clave» que da comienzo a una nueva etapa para la primera vacuna desarrollada en España, «cuya fabricación y suministro va a permitir seguir luchando frente a la pandemia en todo el mundo».
Publicidad
Publicidad
Te puede interesar
Detenida la influencer Marta Hermoso por un robo millonario en un hotel de Madrid
El Norte de Castilla
Publicidad
Publicidad
Esta funcionalidad es exclusiva para registrados.
Reporta un error en esta noticia

Debido a un error no hemos podido dar de alta tu suscripción.
Por favor, ponte en contacto con Atención al Cliente.

¡Bienvenido a BURGOSCONECTA!

Tu suscripción con Google se ha realizado correctamente, pero ya tenías otra suscripción activa en BURGOSCONECTA.
Déjanos tus datos y nos pondremos en contacto contigo para analizar tu caso

¡Tu suscripción con Google se ha realizado correctamente!
La compra se ha asociado al siguiente email
Comentar es una ventaja exclusiva para registrados
¿Ya eres registrado?
Inicia sesiónNecesitas ser suscriptor para poder votar.