
Secciones
Servicios
Destacamos

Julia Fernández
Viernes, 15 de diciembre 2023, 16:28
El Comité de Productos de Uso Humano de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha recomendado este viernes que se use un revolucionario tratamiento genético contra dos enfermedades causada por errores en el ADN del paciente. Son la anemia de ... células falciformes y la beta talasemia, que afecta a la sangre y puede llevar a la muerte a los afectados.
El nuevo método de abordarlas recibe el nombre de 'Casgevy', una terapia de edición genética con tecnología CRISPR/Cas9. Y su aplicación liberaría a los pacientes de tener que realizarse transfusiones frecuentes y de sufrir las consecuentes crisis vasooclusivas, que ocurren cuando los glóbulos rojos falciformes bloquean los vasos sanguíneos pequeños. Por lo que la calidad de vida de estas personas mejoraría ostensiblemente.
Normalmente, los afectados por estas dos enfermedades con 12 años o más suelen someterse a trasplante de células madre hematopoyéticas, pero no siempre son tan rápidos como necesarios por falta de donantes adecuados o por no estar disponibles en esos momentos. En estos casos, la nueva terapia sería la manera de actuar ideal.
La recomendación de la EMA se basa en dos ensayos llevados a cabo en un grupo de pacientes de 12 a 35 años. En el primero, se incluyeron en el conjunto primario de eficacia 42 pacientes, incluidos 13 adolescentes, con beta talasemia dependiente de transfusiones que recibieron una dosis única. De estos 42 pacientes, 39 estuvieron libres de más transfusiones durante al menos un año. En el segundo ensayo, se incluyeron en el conjunto primario de eficacia 29 pacientes, incluidos seis adolescentes, que padecían con anemia de células falciformes grave. De estos 29 pacientes, 28 estuvieron libres de episodios de crisis vasooclusivas durante al menos 12 meses consecutivos.
'CASGEVY'
Qué es Una terapia génica basada en células medicamento que utiliza tecnología CRISPR/Cas9 para editar las células madre sanguíneas del propio paciente. Es un tratamiento único y personalizado.
Eficacia Para evaluarla, Vertex tendrá que presentar los resultados finales en agosto de 2026. Los pacientes tratados en los ensayos recibirán un seguimiento durante 15 años.
Efectos secundarios Niveles bajos de glóbulos blancos y plaquetas, enfermedad hepática, náuseas, vómitos, dolor de cabeza y llagas en la boca.
La seguridad de 'Casgevy' se evaluó en dichos ensayos con 97 personas. Y sus principales efectos secundarios fueron niveles bajos de glóbulos blancos y plaquetas, enfermedad hepática, náuseas, vómitos, dolor de cabeza y llagas en la boca. Todos ellos, según la EMA, se deben a los medicamentos necesarios para que las células sanguíneas modificadas en el laboratorio se injerten y reemplacen a las no modificadas.
La farmacéutica encargada de los ensayos, Vertex Pharmaceutical, se ha mostrado muy satisfecha con la recomendación de la institución. Su vicepresidenta ejecutiva, Nia Tatsis, ha afirmado que «esta opinión positiva es otro importante hito» médico que puede mejorar la calidad de los pacientes con estas dos enfermedades.
Eso sí, la recomendación de la EMA no es el espaldarazo definitivo para su uso en los afectados, sino un paso intermedio. Ahora tiene que ser la Comisión Europea (CE) la que diga si autoriza la comercialización en la UE. Con ella en la mano, las decisiones sobre el precio y el reembolso las tomará cada estado miembro, teniendo en cuenta el papel o el uso potencial de este medicamento en el contexto de su sistema nacional de salud.
Desde 2018, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS), dependiente del Ministerio de Sanidad, ha autorizado cuatro ensayos clínicos en España con células sometidas a estas técnicas tan prometedoras de edición genómica, tres de ellos con CRISPR/Cas (la tecnología usada en 'Casgevy') y uno con el sistema TALEN (transcription activator-like effector nuclease/nucleasa efectora de tipo activador de la transcripción).
En Estados Unidos, la Administración de Alimentos y Medicamentos de Estados Unidos (la FDA, por sus siglas en inglés) aprobó el uso de 'Casgevy' a principios de mes. En octubre se presentó al examen de este organismo que, tras dos meses de estudio y deliberación, ha decidido darle luz verde. Durante este tiempo, se dedicó una sesión de siete horas a profundizar en si los métodos utilizados por Vertex y CRISPR Therapeutics tienen el potencial riesgo de realizar cambios indeseados en el ADN. Para el regulador sanitario estadounidense era prioritario garantizar que no fuera así.
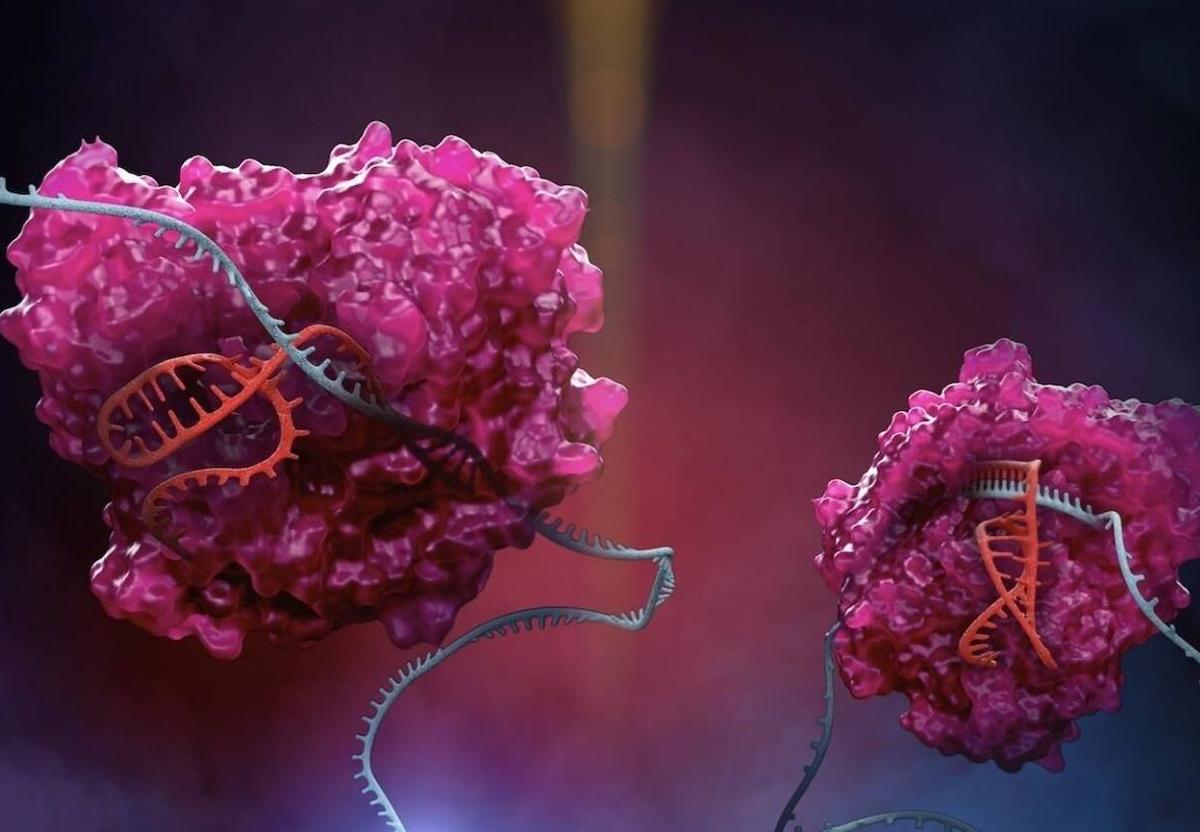
'Casgevy' es una terapia génica basada en células medicamento que utiliza tecnología CRISPR/Cas9 para editar las células madre sanguíneas del propio paciente. Se trata de un tratamiento único y personalizado que consiste en movilizar células madre de la médula ósea a partir de la sangre del paciente. La edición de genes CRISPR encuentra una secuencia específica de ADN dentro de una célula. Utilizando 'tijeras moleculares' para realizar cortes precisos, permite agregar, eliminar o alterar material genético en esa ubicación específica del genoma de las células.
Así, las células madre se editan en la región potenciadora específica de los eritroides del gen BCL11A que normalmente previene la producción de hemoglobina fetal (HbF). Estas células modificadas luego se infunden nuevamente en el paciente y la reducción de la transcripción del gen BCL11A conduce a un aumento de la producción de HbF, proporcionando así hemoglobina funcional. Lo que mejora la calidad de vida del paciente.
Publicidad
Publicidad
Te puede interesar
La bodega del siglo XIV que elabora vino de 20 años y el primer vermut de Valladolid
El Norte de Castilla
La proteína clave para la pérdida de grasa
El Comercio
Publicidad
Publicidad
Esta funcionalidad es exclusiva para suscriptores.
Reporta un error en esta noticia
Comentar es una ventaja exclusiva para registrados
¿Ya eres registrado?
Inicia sesiónNecesitas ser suscriptor para poder votar.